Le illustrazioni nel documento riservato al personale sanitario
Firenze, 7 dicembre 2020 - Il vaccino anti Covid Pfizer/BioNTech ha ricevuto il via libera nel Regno Unito. E' stato il primo ad essere autorizzato da Mhra, l’istituzione inglese indipendente dall’Agenzia europea per i medicinali (Ema). Per l'ok è stata utilizzata una procedura autorizzativa d’emergenza, basata su una rolling review (revisione ciclica continua).
Pur essendo il vaccino americano, questa scelta è stata scartata anche da Food and Drug Administration, l’ente governativo statunitense per la regolamentazione dei farmaci. Ema si prende più tempo per valutare i dati: la decisione potrebbe arrivare per il vaccino Pfizer entro il 29 dicembre, per quello di Moderna entro il 12 gennaio. Noi siamo andati a cercare fra i documenti del governo britannico: abbiamo trovato le indicazioni ufficiali fornite al personale sanitario. Per la prima volta, si leggono nero su bianco possibili interazioni, effetti collaterali, modalità di somministrazione del vaccino Pfizer, dati di efficacia, persone arruolate nelle fasi di sperimentazione.
Immunizzazione
Il vaccino dev'essere somministrato due volte a distanza di almeno 21 giorni. L'immunizzazione si ottiene 7 giorni dopo l'inoculazione della seconda dose. Non è stata studiata l’intercambiabilità con altri vaccini anti Covid: quindi chi effettua la prima vaccinazione con una dose Pfizer, deve fare il richiamo sempre con lo stesso vaccino. La somministrazione viene effettuata con iniezione intramuscolare nel deltoide: sul braccio.
Chi può farlo
Il vaccino può essere somministrato alle persone di età superiore ai 16 anni. Le donne incinta o nel periodo dell’allattamento non possono farlo. Le donne in età fertile dovrebbero evitare gravidanze fini a due mesi dopo aver ricevuto la seconda dose vaccinale.
Reazioni avverse
Occorre segnalare al medico qualsiasi eventuale reazione allergica: dall'arrossamento della pelle al respiro corto, al rigonfiamento del volto o della lingua.
Prima del vaccino
Prima della somministrazione sono da valutare con il proprio medico: eventuali reazioni allergiche a una precedente somministrazione del vaccino, presenza di grave malattia o febbre elevata in corso (mentre febbri intermedie o malattie come raffreddore o da infezioni delle vie aeree superiori non giustificano il rinvio della vaccinazione), situazione di immunodepressione, disturbi di sanguinamento o della coagulazione o uso di farmaci anticoagulanti.
Effetti collaterali
Tra gli effetti ricorrenti, che si manifestano in più del 10% delle persone che effettuano il vaccino: dolore nella zona dove viene effettuata l'iniezione, sensazione di stanchezza, mal di testa, dolori muscolari, dolori articolari, brividi, febbre. Tra gli effetti comuni, manifestati dal 10% di chi riceve il vaccino: gonfiore e/o arrossamento nel punto dove viene effettuata l'iniezione, arrossamento nel punto di iniezione, nausea. Tra gli effetti non comuni, manifrestati da più dell'1% di chi fa il vaccino: ingrossamento dei linfonodi, malessere generalizzato.
Avvertenze
Questo medicinale non ha un'autorizzazione per essere commercializzato, ma è stata concessa un'autorizzazione per la fornitura temporanea da parte del ministero della Sanità e dell'assistenza sociale del Regno Unito dall'Agenzia di regolamentazione per l'immunizzazione attiva per prevenire la malattia Covid 19 causata dal virus SARS-CoV-2 in individui di età pari o superiore a 16 anni. Come con qualsiasi nuovo medicinale nel Regno Unito, questo prodotto sarà attentamente monitorato per consentire una rapida identificazione di nuove informazioni sulla sicurezza. Gli operatori sanitari sono invitati a segnalare qualsiasi sospetta reazione avversa.
Profilo di sicurezza
La sicurezza del vaccino COVID-19 mRNA BNT162b2 è stata valutata in partecipanti di 16 anni di età e più anziani in due studi clinici condotti negli Stati Uniti, Europa, Turchia, Sud Africa e Sud America. Lo studio BNT162-01 (Studio 1) ha arruolato 60 partecipanti, di età compresa tra 18 e 55 anni. Lo studio C4591001 (Studio 2) ha arruolato circa 44.000 partecipanti, di età pari o superiore a 12 anni. Nello Studio 2, un totale di 21.720 partecipanti di età pari o superiore a 16 anni ha ricevuto almeno una dose di COVID-19 mRNA Vaccine BNT162b e 21.728 partecipanti di età pari o superiore a 16 anni hanno ricevuto placebo. Su di questi, al momento dell'analisi, 19.067 (9531 COVID-19 mRNA Vaccine BNT162b2 e 9536 placebo) sono stati valutati per la sicurezza 2 mesi dopo la seconda dose di vaccino COVID-19 mRNA BNT162b2.Caratteristiche demografiche Tra i partecipanti alla sperimentazione che hanno ricevuto il vaccino mRNA COVID-19 e quelli che hanno ricevuto il placebo le caratteristiche demografiche erano generalmente simili per quanto riguarda età, sesso, razza ed etnia. Complessivamente, tra i partecipanti che hanno ricevuto il vaccino COVID-19 mRNA BNT162b2, il 51,5% è di sesso maschile e il 48,5% femminile, l'82,1% bianchi, il 9,6% neri o afroamericani, il 26,1% ispanici / latini, il 4,3% asiatici e lo 0,7% nativi americani / dell'Alaska.
Reazioni avverse
Le reazioni avverse più frequenti nei partecipanti di età pari o superiore a 16 anni sono state dolore durante l'iniezione (> 80%), affaticamento (> 60%), mal di testa (> 50%), dolori muscolari (> 30%), brividi (> 30%), dolori articolari (> 20%), febbre molto alta (> 10%) e sono stati generalmente di intensità lieve o moderata e si sono risolti entro pochi giorni dopo la vaccinazione.
Efficacia
Le informazioni si basano sui partecipanti dai 16 anni in su. In questa analisi, rispetto al placebo, l'efficacia di COVID-19 Vaccino mRNA BNT162b2 nei partecipanti con o senza evidenza di precedente infezione da SARS-CoV-2 è stata del 94,6% (intervallo compreso tra 89,9% e 97,3%). Non ci sono state differenze cliniche significative nell'efficacia complessiva del vaccino nei partecipanti che erano a rischio di malattia COVID-19 grave, compresi quelli con una o più comorbilità che aumentano il rischio di casi gravi (come asma, obesità, malattia polmonare cronica, diabete mellito, ipertensione). Esclusi dalla sperimentazione individui immunodepressi e persone con gravi patologie. Arruolati pazienti positivi per Hiv, Hcv ed epatite B (Hbv).
Il prodotto
Ogni fiala multidose deve essere diluita prima dell'uso. Un flaconcino (0,45 ml) contiene 5 dosi di 30 microgrammi di BNT162b2 RNA (incorporato in nanoparticelle lipidiche). Il vaccino Covid-19 mRNA BNT162b2 è un RNA messaggero a filamento singolo altamente purificato, con cappuccio 5' (mRNA) prodotto mediante trascrizione in vitro priva di cellule dai corrispondenti modelli di Dna, codificanti la proteina virale spike (S) di SARS-CoV-2.
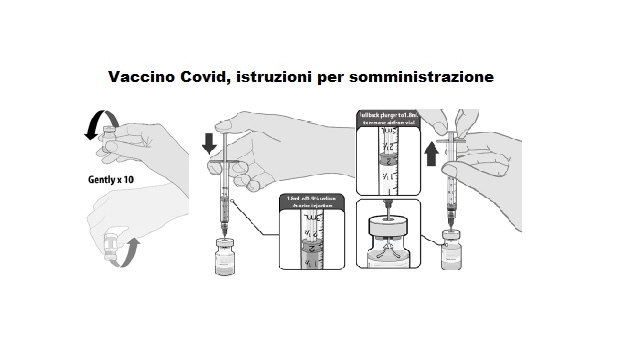
Tutte le fasi di preparazione
1) Le fiale congelate devono essere trasferite a una temeratura fra 2 gradi e 8 per lo scongelamento; una confezione da 195 flaconcini può richiedere tre ore per scongelare. In alternativa, le fiale possono anche essere scongelate per 30 minuti a temperature fino a 25 gradi per un utilizzo immediato. Una volta scongelato, il vaccino non diluito può essere conservato per un massimo di 5 giorni a una temperatura compresa tra 2 e 8 gradi e fino a 2 ore a temperature fino a 25 gradi.
2) Prima della diluizione la fiala deve essere capovolta delicatamente 10 volte. Non agitare. Prima della diluizione il il vaccino dovrebbe presentarsi come una soluzione biancastra senza particolato visibile. Scartare il vaccino se sono presenti particolato o alterazione del colore.
3) Il vaccino scongelato deve essere diluito nel suo flaconcino originale con 1,8 ml di cloruro di sodio (soluzione fisiologica), soluzione iniettabile 9 mg / ml (0,9%), utilizzando un ago di calibro 21 o più stretto. Avvertenza: cloruro di sodio senza conservanti: la soluzione iniettabile 9 mg / ml (0,9%) è il solo diluente che dovrebbe essere usato. Questo diluente non è fornito nella confezione del vaccino.
4) Equalizzare la pressione della fiala prima di rimuovere l'ago dalla fiala prelevando 1,8 ml di aria nella siringa vuota.
5) Capovolgere delicatamente la soluzione diluita 10 volte. Fare attenzione a non agitare.
6) Il vaccino diluito dovrebbe presentarsi come una soluzione bianco sporco senza particolato visibile. Gettare il vaccino diluito se visibile particolato o sono presenti segni di scolorimento.
7) I flaconcini diluiti devono essere contrassegnati con data e ora e conservati a una temperatura compresa tra 2 e a 25 gradi. Utilizzare immediatamente o entro 6 ore dalla diluizione.
8) Dopo la diluizione, la fiala contiene 5 dosi da 0,3 ml. Prelevare la dose necessaria di 0,3 ml di vaccino diluito utilizzando una siringa con ago sterile e buttare il vaccino inutilizzato rimasto nella fiala 6 ore dopo la diluizione.

